Tế bào gốc là gì? Vai trò và ứng dụng của tế bào gốc trong y học
Tác giả: Ngô Thị Thúy An , bài viết được tư vấn chuyên môn bởi: TS.BS Takaaki Matsuoka Viện trưởng Trung tâm tế bào gốc Helene
Tế bào gốc từ khi được khám phá đã làm thay đổi cách nghĩ của chúng ta về y học tái tạo và công nghệ sinh học. Nhờ khả năng tái tạo và phát triển thành mọi loại tế bào trong cơ thể, tế bào gốc có thể khắc phục nhiều nhược điểm mà các phương pháp truyền thống chưa thể đáp ứng được. Tuy nhiên, việc nghiên cứu và ứng dụng tế bào gốc còn đầy thách thức và cần sự cẩn trọng. Dưới đây là một cái nhìn tổng quan về tế bào gốc và tiềm năng của chúng trong lĩnh vực y học và nghiên cứu.
Nội dung bài viết
Tế bào gốc là đại diện tiêu biểu của y học tái sinh với khả năng tăng sinh, biệt hoá đa dạng
1. Tế bào gốc là gì?
Tế bào gốc là loại tế bào có thể phân chia và biệt hóa thành mọi tế bào của cơ thể trưởng thành. Trong cơ thể tế bào gốc có vai trò như một hệ thống sửa chữa, tái tạo thay thế các tế bào bị mất hoặc hư hỏng trong suốt cuộc đời con người.
Tế bào gốc (stem cell) (1) được ví như nguyên liệu thô của cơ thể, là những tế bào có khả năng biệt hoá thành các tế bào chức năng chuyên biệt để đảm nhận vai trò tương ứng từng cơ quan. Ở điều kiện thích hợp trong phòng thí nghiệm, các tế bào gốc phân chia để tạo thành nhiều tế bào hơn gọi là tế bào con.
Những tế bào con này trở thành tế bào chuyên biệt hoặc tế bào mới với chức năng cụ thể hơn, chẳng hạn như tế bào não, tế bào cơ tim, tế bào máu hoặc tế bào xương. Không có tế bào nào khác trong cơ thể có khả năng tự nhiên tạo ra các loại tế bào mới như tế bào gốc.
2. Phân loại tế bào gốc theo nguồn gốc
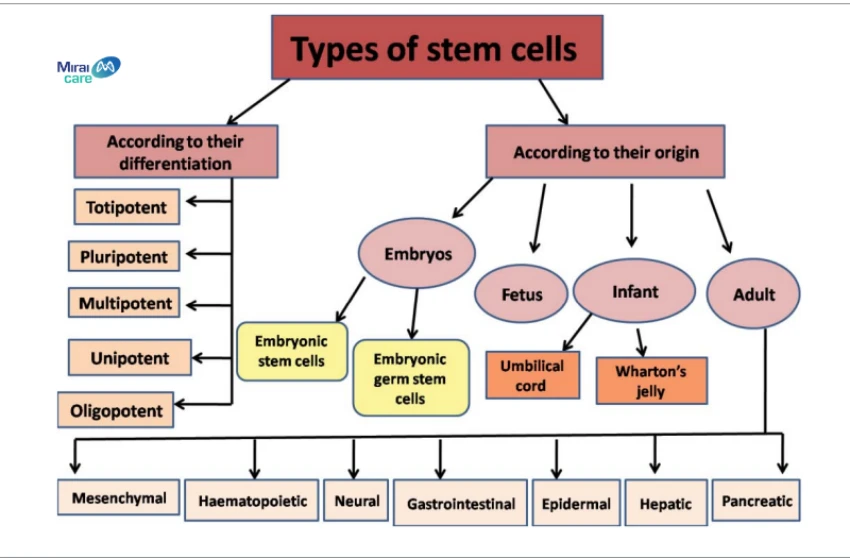
Bảng 1: Phân loại tế bào gốc theo nguồn gốc,Nguồn: Nghiên cứu về tế bào gốc theo American Journal of Pharmacology & Therapeutics
Tìm hiểu về những nguồn gốc của tế bào gốc trên cơ thể người:
2.1. Tế bào gốc phôi (ESCs)
Tế bào gốc phôi có 3 loại khác nhau bao gồm:
- Tế bào gốc phôi: Tế bào gốc phôi được lấy từ phôi thai khoảng 3 đến 5 ngày tuổi. Ở giai đoạn này, phôi còn được gọi là phôi nang và chứa khoảng 150 tế bào. Đây là những tế bào đa năng, có thể phân chia thành nhiều tế bào gốc hơn hoặc có thể trở thành mọi loại tế bào trong cơ thể. Nhờ đặc tính linh hoạt này, tế bào gốc phôi thường được ứng dụng để tái tạo hoặc sửa chữa các mô, cơ quan bị bệnh. Có nguồn gốc từ khối tế bào mầm phôi của phôi nang cũng chính là điểm khác biệt của tế bào gốc phôi so với tế bào gốc trưởng thành.
- Tế bào mầm phôi (EG): Được lấy từ giai đoạn sau của tế bào phát triển phôi. Chúng có nguồn gốc từ Tế bào mầm nguyên thủy (PGC) trong giai đoạn phát triển ban đầu và được phân lập từ mô bào thai ở thời gian cửa sổ hẹp. Các tế bào có nguồn gốc PGC là đa năng, mặc dù không thể chứng minh được tính đa năng bằng tạo ra khối u quái ở chuột.
- Tế bào gốc của thai nhi: Là loại tế bào nguyên thủy được tìm thấy trong các cơ quan của thai nhi. Chúng có khả năng biệt hóa thành tế bào gốc đa năng và tế bào gốc tạo máu.
2.2. Tế bào gốc trưởng thành
Tế bào gốc trưởng thành tồn tại với số lượng nhỏ trong hầu hết các mô trưởng thành, chẳng hạn như mỡ hoặc tủy xương. So với tế bào gốc phôi, tế bào gốc trưởng thành hạn chế hơn về khả năng tạo ra các tế bào khác nhau của cơ thể.
Cho đến gần đây, các nhà nghiên cứu vẫn nghĩ rằng tế bào gốc trưởng thành chỉ có thể tạo ra các loại tế bào tương tự. Ví dụ như tế bào gốc trong tủy xương chỉ có thể tạo ra tế bào máu. Tuy nhiên, nhiều bằng chứng khoa học vẫn cho thấy tế bào gốc trưởng thành có thể tạo ra nhiều loại tế bào khác nhau. Ví dụ, các tế bào gốc tủy xương ngoài tạo ra tế bào xương còn có thể tạo ra tế bào cơ tim.
Các loại của tế bào gốc trưởng thành bao gồm:
- Tế bào gốc trung mô (MSC): Là các tế bào gốc đa năng có thể biệt hóa thành nhiều loại tế bào khác nhau, bao gồm tế bào xương (nguyên bào xương), tế bào sụn, tế bào cơ, tế bào mỡ tạo ra mô mỡ tủy,... MSC có thể được phân lập từ tủy xương và dễ dàng tách ra khỏi tế bào gốc tạo máu do khả năng bám dính của chúng. Đây là loại tế bào gốc được sử dụng phổ biến trong y học tái tạo.
- Tế bào gốc tạo máu: Là những tế bào có khả năng tự làm mới và có khả năng tạo ra các tế bào biệt hóa của tất cả các dòng tạo máu. Do đó, họ đã cấy ghép để chữa lành hoàn toàn các rối loạn về huyết học và sau khi hóa trị liệu liều cao chống lại các bệnh ác tính.
- Tế bào gốc thần kinh: Là tế bào đa năng và tự tái tạo, chúng được thiết lập trong môi trường vi mô phân tử chuyên biệt trong não động vật có vú trưởng thành. Chúng có thể thể hiện vai trò tiềm năng trong liệu pháp tế bào của não.
- Tế bào gốc đường tiêu hóa: Các tế bào gốc của đường tiêu hóa cư trú trong một “ngách” trong các hầm ruột và tuyến dạ dày. Cơ chế và hướng khuếch tán của dòng vô tính đã chuyển đổi này vào niêm mạc đường tiêu hóa đang được tranh cãi gay gắt, và trọng tâm của trường hợp này là vị trí và bản chất của tế bào gốc đường tiêu hóa.
- Tế bào gốc biểu bì: Lớp biểu bì của động vật có vú là một mô trẻ hóa nhanh chóng bao gồm ba loại tế bào sừng với khả năng biệt hóa khác nhau: tế bào gốc biểu bì, Tế bào khuếch đại thoáng qua (tế bào TA) và tế bào biệt hóa ở giai đoạn cuối. Chúng có vai trò trong việc duy trì cân bằng nội môi và tái tạo tế bào của làn da bình thường; chữa lành vết thương và hình thành khối u, trong khi tế bào TA trải qua quá trình biệt hóa cuối cùng sau 3 -5 lần phân chia. Sau khi phân chia, các tế bào TA rời khỏi lớp cơ bản và di chuyển qua các lớp trên lớp nền đến bề mặt mô, nơi chúng bong ra theo định kỳ dưới dạng vảy.
- Tế bào gốc gan: Gan có khả năng tái tạo mạnh mẽ, sử dụng các phương thức tái tạo khác nhau tùy theo loại và mức độ tổn thương. Các tế bào gan trưởng thành có thể nhân lên để thay thế các mô bị tổn thương cho phép phục hồi chức năng nhu mô. Tổn thương gan mãn tính làm phát sinh một khoang tế bào gốc tiềm năng nằm ở các nhánh nhỏ nhất của đường mật trong gan đang được kích hoạt, gọi là phản ứng ống tế bào bầu dục. Những tế bào hình bầu dục này có nguồn gốc từ ống Hering, giúp khuếch đại các quần thể đường mật này trước khi các tế bào này biệt hóa thành tế bào gan. Ở gan người, tổ chức của đường mật thì khác, với ống dẫn kéo dài đến một phần ba gần của tiểu thùy và do đó rõ ràng cần phải đổi tên từ tế bào hình bầu dục thành tế bào tiền thân của gan.
- Tế bào gốc tuyến tụy: Các tế bào sản xuất insulin trước đây được tạo ra từ tế bào gốc đa năng. Việc tạo ra các tế bào này sẽ cung cấp nguồn tế bào mới cho việc phát triển thuốc và liệu pháp cấy ghép tế bào ở những người mắc bệnh tiểu đường. Các tế bào beta sản xuất insulin thay đổi chu kỳ 40-50 ngày một lần bằng quá trình apoptosis cũng như sự nhân lên và biệt hóa của các tế bào đảo mới từ các tế bào biểu mô tiền thân, nằm trong ống tụy.
2.3. Tế bào gốc từ máu và mô dây rốn
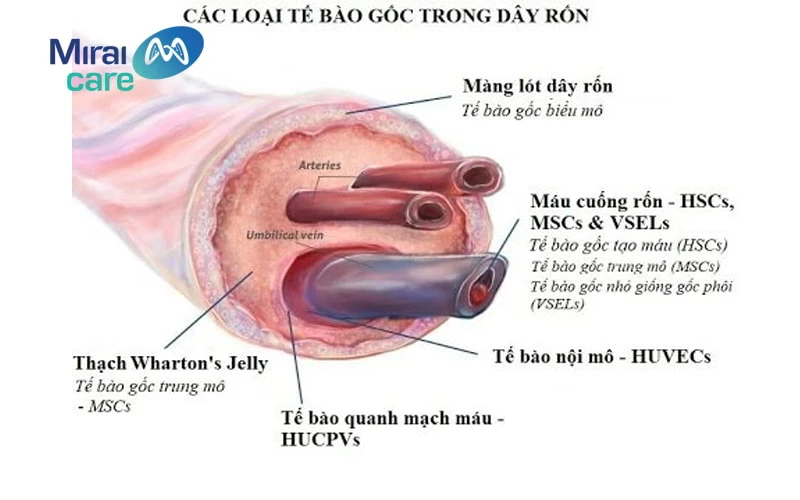
Tế bào gốc từ máu và mô dây rốn được thu nhận ngay khi đứa trẻ chào đời
Nếu như trước đây dây rốn của trẻ sơ sinh thường được xem là “rác thải y tế” và bị bỏ đi sau khi bé chào đời thì hiện nay với công nghệ hiện đại, dây rốn có thể được giữ lại để chiết tách, tăng sinh và lưu trữ thành nguồn tế bào gốc quý giá. Việc lưu trữ chỉ có thể thực hiện khi trẻ vừa được sinh ra, vì vậy đây là cơ hội duy nhất trong cuộc đời của trẻ mà ba mẹ có thể đầu tư.
Tế bào gốc từ máu và mô dây rốn được các nhà khoa học đánh giá cao vì còn rất non trẻ (0 tuổi). Chúng có khả năng tăng sinh, biệt hóa, thích ứng cao hơn so với tế bào gốc trưởng thành. Ngoài ra, loại tế bào này còn có khả năng đáp ứng miễn dịch, thích ứng với cơ thể người thân cao hơn so với nguồn tế bào gốc ngoại sinh không cùng huyết thống
3. Những đặc tính sinh học của tế bào gốc
Tất cả các tế bào gốc được tìm thấy trong mọi hệ thống sống đều có ba đặc tính quan trọng. Những đặc tính này có thể được hình dung trong ống nghiệm bằng một quá trình gọi là xét nghiệm nhân bản, trong đó một tế bào được đánh giá về khả năng biệt hóa.
Sau đây là 3 đặc tính riêng biệt của tế bào gốc, mà tế bào thông thường không có:
- Tế bào gốc thuộc mọi nguồn gốc, đều có khả năng tự phân chia và tự đổi mới trong thời gian dài. Những tế bào này trải qua một thời kỳ tăng sinh tế bào trong khi vẫn duy trì trạng thái không phân biệt.
- Tế bào gốc không chuyên biệt nên không thể thực hiện các chức năng cụ thể trong cơ thể
- Khả năng biệt hóa: Tế bào gốc có khả năng biệt hóa thành các tế bào chuyên biệt cùng nhau tạo nên các loại mô khác nhau, như tế bào cơ, tế bào máu và tế bào não.
4. Sự di chuyển của tế bào gốc trong cơ thể
Tế bào gốc có thể rời khỏi hốc và lưu thông trong máu sau kích thích cụ thể. Sau đó tế bào này phải bị thu hút bởi một tế bào khác địa điểm, trong những hoàn cảnh môi trường vi mô cụ thể có thể tham gia chương trình khác biệt hóa của nó. Tế bào gốc MSC cũng được mô tả là di cư cục bộ đến các địa điểm bị thương để hỗ trợ quá trình tái sinh.
Những trường hợp như vậy đã được ghi nhận trong quá trình sửa chữa sụn, tái tạo cơ và tim, di chuyển khắp não và tiểu não và biệt hóa thành các nguyên bào xương trong quá trình tái tạo xương.
Khả năng di chuyển của MSC có thể giảm sau khi mở rộng nuôi cấy trong môi trường ông nghiệm
5. Ứng dụng của tế bào gốc
5.1. Ứng dụng tế bào gốc trong y học tái tạo và nghiên cứu các cơ chế bệnh lý
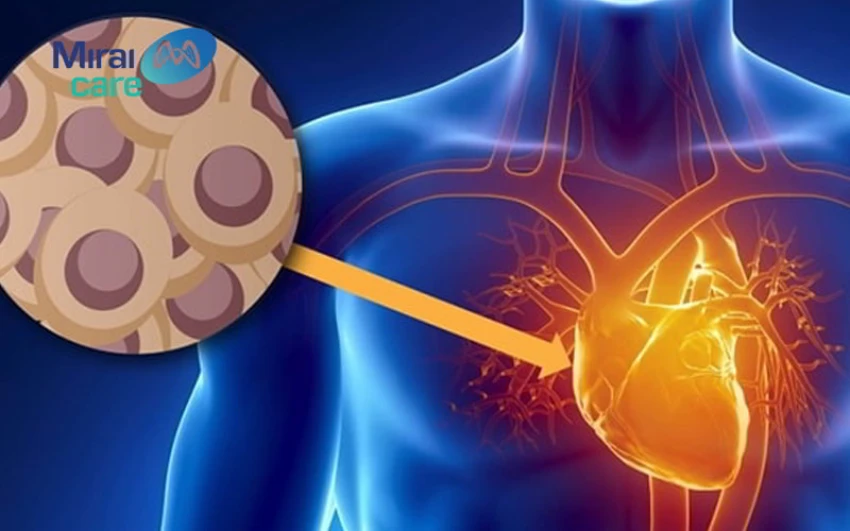
Tế bào gốc được ứng dụng để điều trị nhiều bệnh lý, trong đó có tim mạch
Tế bào gốc được xem là ứng cử viên sáng giá trong y học tái tạo vì có thể được sử dụng để tái tạo, sửa chữa các mô đã bị tổn thương hoặc bị ảnh hưởng bởi bệnh tật. Những người có thể được hưởng lợi từ liệu pháp này bao gồm: Người bị chấn thương tủy sống, ứng dụng tế bào gốc điều trị bệnh tiểu đường tuýp 1, bệnh Parkinson, bệnh xơ cứng teo cơ bên, bệnh Alzheimer, bệnh tim, đột quỵ, bỏng, viêm xương khớp và ung thư, thoái hóa khớp gối...
Bằng cách quan sát quá trình tế bào gốc phát triển thành các tế bào trong xương, cơ tim, dây thần kinh và những mô, cơ quan khác, các nhà khoa học có thể hiểu rõ hơn về cơ chế hình thành và phát triển của bệnh tật. Từ đó, những nghiên cứu chữa trị sẽ có thêm nhiều cơ sở trong việc tìm ra giải pháp tối ưu kiểm soát, khắc chế bệnh ở cấp độ tế bào.
5.2. Ứng dụng tế bào gốc trong điều trị bệnh
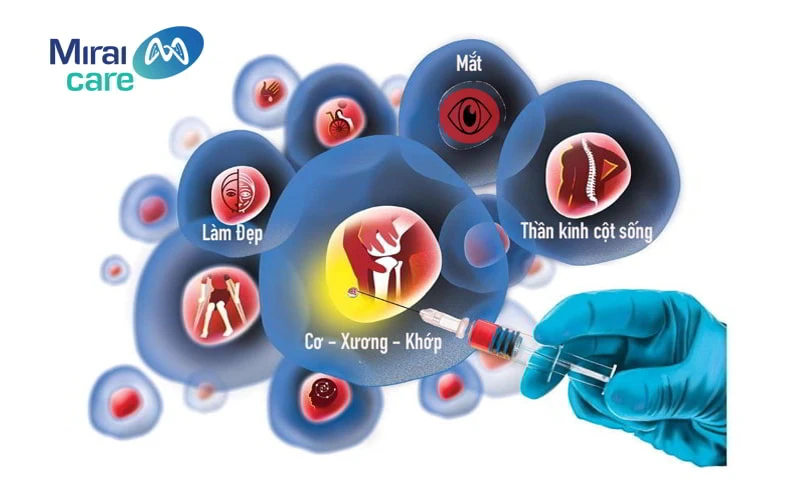
Tính đến thời điểm hiện tại, công nghệ tế bào gốc được ứng dụng trong nhiều lĩnh vực của y khoa, từ hỗ trợ điều trị vô sinh đến các ca bệnh khó, bệnh hiểm nghèo.
Một số ứng dụng tế bào gốc trong điều trị các bệnh mãn tính hiện nay: Ứng dụng tế bào gốc trong điều trị lupus ban đỏ, điều trị khớp gối, hỗ trợ điều trị ung thư, điều trị bệnh tiểu đường (tuýp I, tuýp II), điều trị rối loạn cương dương, hỗ trợ thụ tinh trong ống nghiệm, điều trị bệnh suy tim, điều trị bệnh tự miễn và các bệnh khác như suy thận, bại não, đột quỵ, chẩn thương tủy sống.
5.3. Phát triển thuốc
Trước khi sử dụng thuốc thử nghiệm trên người, các nhà nghiên cứu có thể sử dụng một số loại tế bào gốc để kiểm tra độ an toàn và chất lượng của thuốc. Để thử nghiệm các loại thuốc mới được chính xác, tế bào gốc phải được lập trình để thu được các đặc tính của loại tế bào mà thuốc nhắm đến.
Ví dụ, các tế bào thần kinh có thể được tạo ra để thử nghiệm cho một loại thuốc mới chữa bệnh thần kinh. Kết quả thử nghiệm có thể cho biết liệu loại thuốc mới này có ảnh hưởng gì đến tế bào hay không và liệu tế bào có bị tổn hại sau khi sử dụng thuốc hay không.
5.4. Hỗ trợ điều chế các sản phẩm làm đẹp

Làm đẹp da bằng tế bào gốc là xu hướng chăm sóc sắc đẹp hiện đại
Người tiêu dùng lần đầu tiên tiếp xúc với mỹ phẩm tế bào gốc bắt đầu với các sản phẩm chăm sóc da và tóc có chứa các thành phần hoạt tính nguồn gốc từ tế bào gốc thực vật. Hơn một thập kỷ trước, các nhóm nghiên cứu đã đưa ra nhiều bằng chứng chứng minh tác dụng tái tạo của tế bào gốc thực vật và chiết xuất của chúng đối với nguyên bào sợi, tế bào sừng và nang lông trên da, tóc con người. Thế nhưng các sản phẩm này có thật sự chứa tế bào gốc hay không vẫn còn là câu hỏi bỏ ngỏ.
Ở bước phát triển tiếp theo, người tiêu dùng được tiếp xúc với mỹ phẩm tế bào gốc có nguồn gốc động vật. Quy trình này được quảng cáo và sử dụng rộng rãi nhất là huyết tương giàu tiểu cầu (PRP). PRP được tách ra khỏi máu, thông qua quá trình ly tâm để thu được tiểu cầu, protein huyết tương và thành phần giàu yếu tố tăng trưởng. Về mặt lý thuyết, việc áp dụng PRP vào da hoặc nang lông có thể kích thích sự tăng sinh tế bào và tổng hợp ngoại bào. Nhiều tài liệu hiện tại cũng đã cho thấy tác dụng tái tạo của PRP đối với da và tóc. Tuy nhiên vẫn còn thiếu các thử nghiệm lâm sàng có đối chứng quy mô lớn.
Và ở cấp độ cao nhất, việc sử dụng tế bào gốc đồng loại để sản xuất hàng loạt các sản phẩm làm đẹp được chứng minh mang lại hiệu quả thiết thực hơn cả. Hiện nay, có một số sản phẩm được bán ở dạng kem hoặc thuốc tiêm trong da. Các nghiên cứu về cơ chế hoạt động của liệu pháp tế bào gốc cũng đang dần xác nhận rằng chúng có thể phát huy tác dụng tái tạo thông qua việc giải phóng các yếu tố cận tiết. Những yếu tố này kích thích các tế bào nội sinh và thúc đẩy sự hình thành mạch cục bộ tại vị trí mô bị tổn thương. Nhờ vậy làn da được phục hồi, mái tóc được kích thích tăng sinh, giảm gãy rụng.
6. Chức năng của tế bào gốc trong điều trị bệnh
Tế bào gốc cho thấy tiềm năng vô hạn trong điều trị bệnh và làm đẹp
Tế bào gốc thúc đẩy phản ứng sửa chữa các mô bị bệnh hoặc rối loạn chức năng, điều này mở ra nhiều cơ hội trong cấy ghép nội tạng vì có thể sử dụng các tế bào thay cho nội tạng của người hiến tặng với nguồn cung hạn chế.
Để thay thế các tế bào bị tổn thương do hóa trị hoặc bệnh tật, bác sĩ đã tiến hành ghép tế bào gốc hay còn gọi là ghép tủy. Các tế bào này có khả năng kích thích hệ thống miễn dịch chống lại một số loại ung thư và các bệnh liên quan đến máu, chẳng hạn như bệnh bạch cầu, ung thư hạch, u nguyên bào thần kinh và đa u tủy. Những ca cấy ghép này đa phần sử dụng tế bào gốc trưởng thành hoặc máu cuống rốn.
Song song đó, các nhà nghiên cứu còn phát triển tế bào gốc trong phòng thí nghiệm để biệt hóa chúng thành các loại tế bào chuyên biệt, chẳng hạn như tế bào máu, tế bào cơ tim hoặc tế bào thần kinh. Các tế bào chuyên biệt này sau đó có thể được dùng để cấy ghép vào người. Cụ thể nếu một người mắc bệnh tim, tế bào gốc được tiêm vào cơ tim sẽ biệt hóa thành tế bào cơ tim khỏe mạnh góp phần sửa chữa cơ tim bị tổn thương.
7. Những thách thức trong nghiên cứu tế bào gốc và ứng dụng
Tế bào gốc cần được nghiên cứu nhiều hơn nữa trước khi việc sử dụng chúng có thể được mở rộng. Trước tiên, các nhà khoa học phải tìm hiểu thêm về cách tế bào gốc phôi phát triển. Điều này sẽ giúp họ hiểu cách kiểm soát loại tế bào được tạo ra từ chúng. Một thách thức khác là các tế bào gốc phôi hiện nay có khả năng bị cơ thể đào thải. Và một số người thấy việc sử dụng tế bào gốc lấy từ phôi là điều đáng lo ngại về mặt đạo đức.
Các nhà khoa học cũng phải đối mặt với những thách thức khi sử dụng tế bào gốc đa năng trưởng thành. Những tế bào này khó phát triển trong phòng thí nghiệm, vì vậy các nhà nghiên cứu đang tìm cách cải thiện quy trình. Những tế bào này cũng được tìm thấy với số lượng nhỏ trong cơ thể. Có nhiều khả năng chúng có thể chứa các vấn đề về DNA.
Các thử nghiệm lâm sàng sử dụng liệu pháp tế bào gốc hiện đang được thực hiện ở các nước có nền y tế tiên tiến như Hoa kỳ, Nhật Bản... Nếu bạn muốn thử liệu pháp này để điều trị một số bệnh mãn tĩnh, Mirai Care là một địa chỉ tối ưu dành cho bạn
8. Kết luận
Tế bào gốc đã trở thành một nhân tố đầy triển vọng trong lĩnh vực y học. Khả năng tự tái tạo và biệt hoá của loại tế bào đặc biệt này đã mở ra cánh cửa mới trong việc điều trị nhiều bệnh lý phức tạp mà trước đây chưa có phương pháp điều trị hiệu quả. Chúng ta có thể hy vọng vào một tương lai y tế tốt hơn, với nhiều phương pháp điều trị tiên tiến và hiện thực hóa ước mơ “cải lão hoàn đồng” của nhân loại.
Khách hàng muốn tìm hiểu thêm thông tin hoặc nhận tư vấn từ đội ngũ chuyên gia y tế hàng đầu về tế bào gốc, vui lòng liên hệ 18008144 để được Mirai Care tư vấn và kết nối tới các bệnh viện uy tín tại Nhật Bản. Chúng tôi đồng hành cùng khách hàng trong hành trình bảo vệ sức khỏe và nâng cao chất lượng cuộc sống
Câu hỏi thường gặp về tế bào gốc
KẾT QUẢ ĐÁNH GIÁ
Bài viết phổ biến khác







.png)

